
目前,临床上对恶性血液病的诊断采用MICM,即形态学(morphology)、免疫学(immunology)、细胞遗传学(cytogenetics)、分子特征(molecular)对患者进行综合分型以及预后分层。随着现代分子生物学技术的发展,以及测序技术的成熟和应用,基因突变分析成为临床诊疗的新工具,NCCN、ELN、WHO、国内专家共识等重要临床指南中已经将基因突变引入恶性血液肿瘤的危险度预后分层和细化分类中,临床相关的基因在指南更新中所占份额逐年增加。
Ag旗舰厅官网科技集团血液病基因检测项目——“安百”可为医生诊断血液病提供依据,明确血液病患者的基因突变携带情况,为血液病患者预后分层提供参考;辅助诊断骨髓增殖性肿瘤及部分药物用药指导,可以根据基因突变来评估疗效,并选择靶向药物;监测复发和耐药异常。
- 214综合基因检测
- 急性髓细胞白血病(AML)
- 骨髓增生异常综合征(MDS)
- 急性淋巴细胞白血病(ALL)
- 骨髓增殖性肿瘤(MPN)
- 化疗临床获益基因检测

借助于NGS技术,围绕AML进行基因突变检测,为临床提供初诊患者预后分层的依据,预后差异因素的提示、靶向用药相关位点信息以及后续辅助监测患者疾病进展情况的工具。AML具有很大的异质性,在传统MIC分型标准基础上增加了Molecular biology,形成了初期完整的MICM分型体系。然而随着临床数据积累,临床工作者越来越认识到,即使在已有的MICM评估分层体系下,患者间仍存在很大的预后差异:一些患者治疗后表现缓解无复发,而一些治疗后出现难治/复发导致治疗失败。随着NGS的迅猛发展,人们逐渐认识到AML异质性是多层面的,尤其是分子层面对AML差异化提供了丰富的信息。可以对急性白血病进行分型、区分异质性,为临床提供先进的技术方法,从而更好地指导患者的个体化治疗。
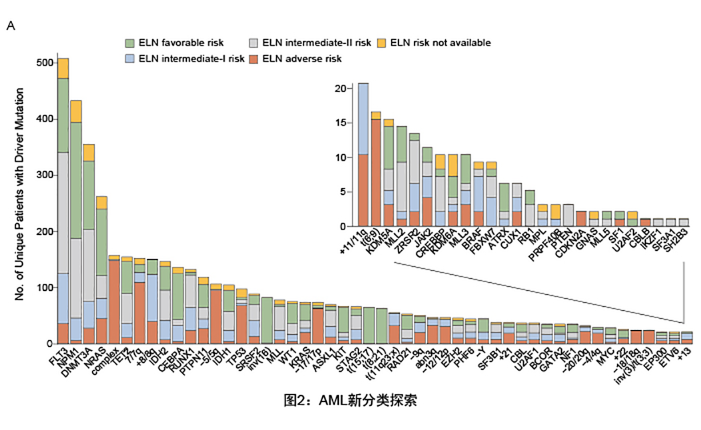
1:已有的8种分类(2008年WHO,占52%)
t(15;17), t(8;21),
inv(16)/t(16;16), t(6;9), inv(3)/t(3;3), MLL fusion genes, CEBPA
和NPM1(临时)。
2:染色体-剪切体组合(18%)
RNA剪切调控因子(SRSF2, SF3B1,U2AF1, and
ZRSR2 ),染色质基因序列 (ASXL1, STAG2,BCOR, MLL-PTD, EZH2, and
PHF6),转录调控基因(RUNX1)。
3:TP53基因突变、染色体非整倍性或两者皆有(13%)
4:含有IDH2基因突变(1%)
特指IDH2,该突变和IDH2R很不相同,它会和NPM1联合出现。
5:其他
交叉分类(56位,4%),无法分类(166位,11%)
由Wellcome
trust基金会牵头的临床研究,对1540位AML患者进行111基因测序,其中52%的患者可以使用传统手段进行分类,而对于余下48%的患者,研究者通过基因突变的分析,做出进一步的分类;最后,结合核型分析、融合基因等传统方法,以及基因突变这个新型标记,研究者共把AML患者分类为11种亚型。研究者表示,接下来会进行更大规模的验证,并与WHO合作,探讨更新指南中基因分型等问题。该成果发表在2016年的NEJM上。
近年来,随着分子组学研究的深入,一些突变已被纳入AML分层体系:CEBPA,NPM1,KIT,FLT3-ITD,TP53,RUNX1,ASXL1等。同时也有研究发现:多基因突变往往是相伴随发生,这种情况下单一突变已不足以指导临床预后,在细胞遗传学基础上的进行多基因联合分析,已逐渐成为临床关注热点,在2022年AML NCCN指南中初始评估中加入“other mutations”筛查,以参与指导AML预后分层。

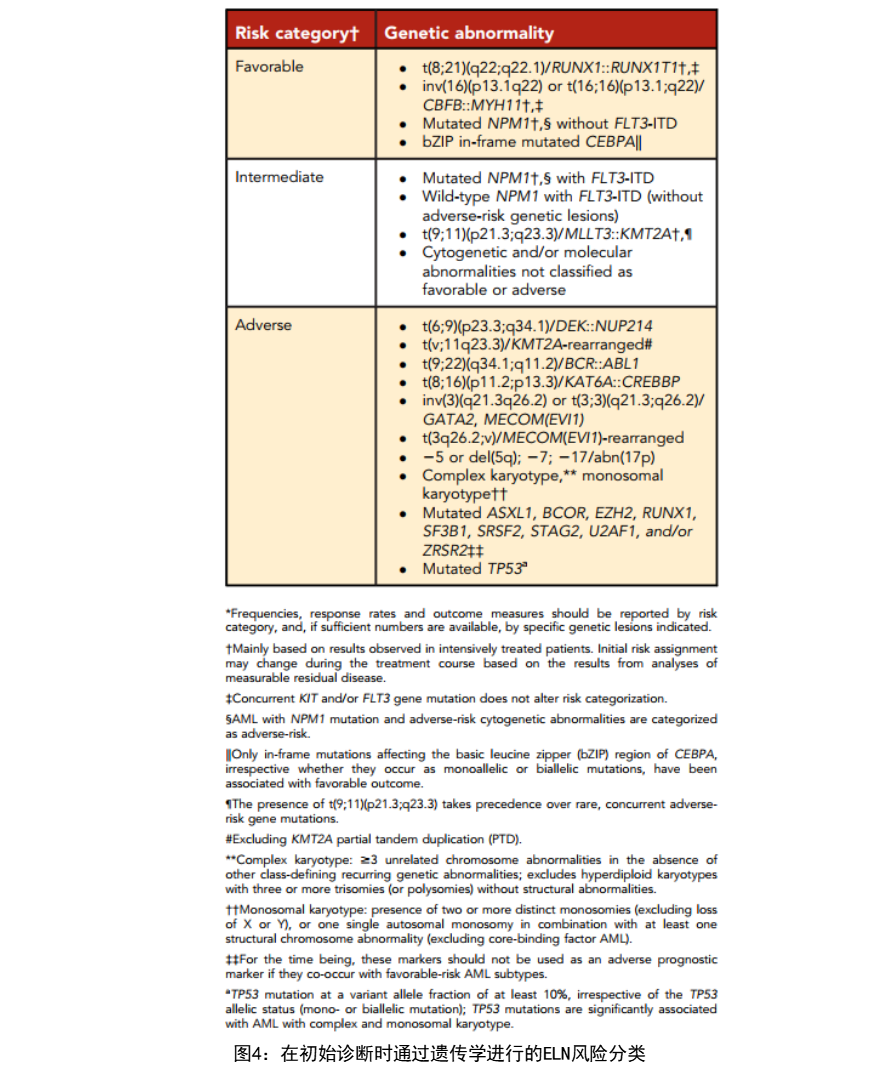
随着临床对基因突变检测使用体会的深入,逐渐认识到基因突变负荷对临床意义的影响。2022 ELN指南中新增加ASXL1、BCOR、EZH2及TP53等基因,同时结合FLT3-ITD和NPM1基因的突变情况,对AML患者预后影响不同,在预后分层中做出了较明确的划分:
| 临床热点 1 | 临床热点 2 |
| CEBPA、 NPM1、 FLT3-ITD、 FLT3、 TP53、 KIT、 DNMT3A、 IDH1、 IDH2、 MLL、 TET2、 RUNX1、 KRAS、 NRAS、 ASXL1、 WT1、 GATA1、 PHF6 | ABCB1、 AKT3、 AMER1、 APC、 ATRX、 BCOR、 BCORL1、 BRAF、 CACNA1E、 CBL、 CBLB、 CDKN2A、 CREBBP、 CRLF2、 CSF1R、 CSF3R、 CUX1、 DIS3、 DNAH9、 EGFR、 ERG、 ETV6、 EZH2、 FAM46C、 FBXW7、 GATA2、 GNAS、 GSTP1、 HRAS、 IKZF1、 JAK1、 JAK2、 KDM6A、 KMT2C、 KMT3A、 MAP2K4、 MLH1、 MPL、 NF2、 NQO1、 NT5C2、 NTRK1、 NTRK2、 PTEN、 PTPN11、 RAD21、 RB1、 SETBP1、 SF3B1、 SH2B3、 SMAD4、 SMC1A、 SMC3、 SRSF2、 STAG2、 STAT5B、 TPMT、 U2AF1、 ZRSR2 |
借助于NGS技术,对MDS相关基因进行基因突变检测,实现为临床提供患者预后评估的参考依据,监测患者疾病进展情况。
MDS的发生发展是一个复杂的、多因素作用的过程,具有很大的异质性。随着NGS测序技术的发展,研究发现突变与MDS的发生、发展密切相关,越来越多的证据支持基因突变能作为分子生物标志来评估预后。近年来研究的深入,新发现的表观遗传学相关突变、剪切因子类突变被证实在MDS的发生发展中起着重要的作用。此外还有越来越多的研究已证实这些常见种类的突变对MDS分层及预后生存产生影响(见MDS 2023 NCCN指南)。
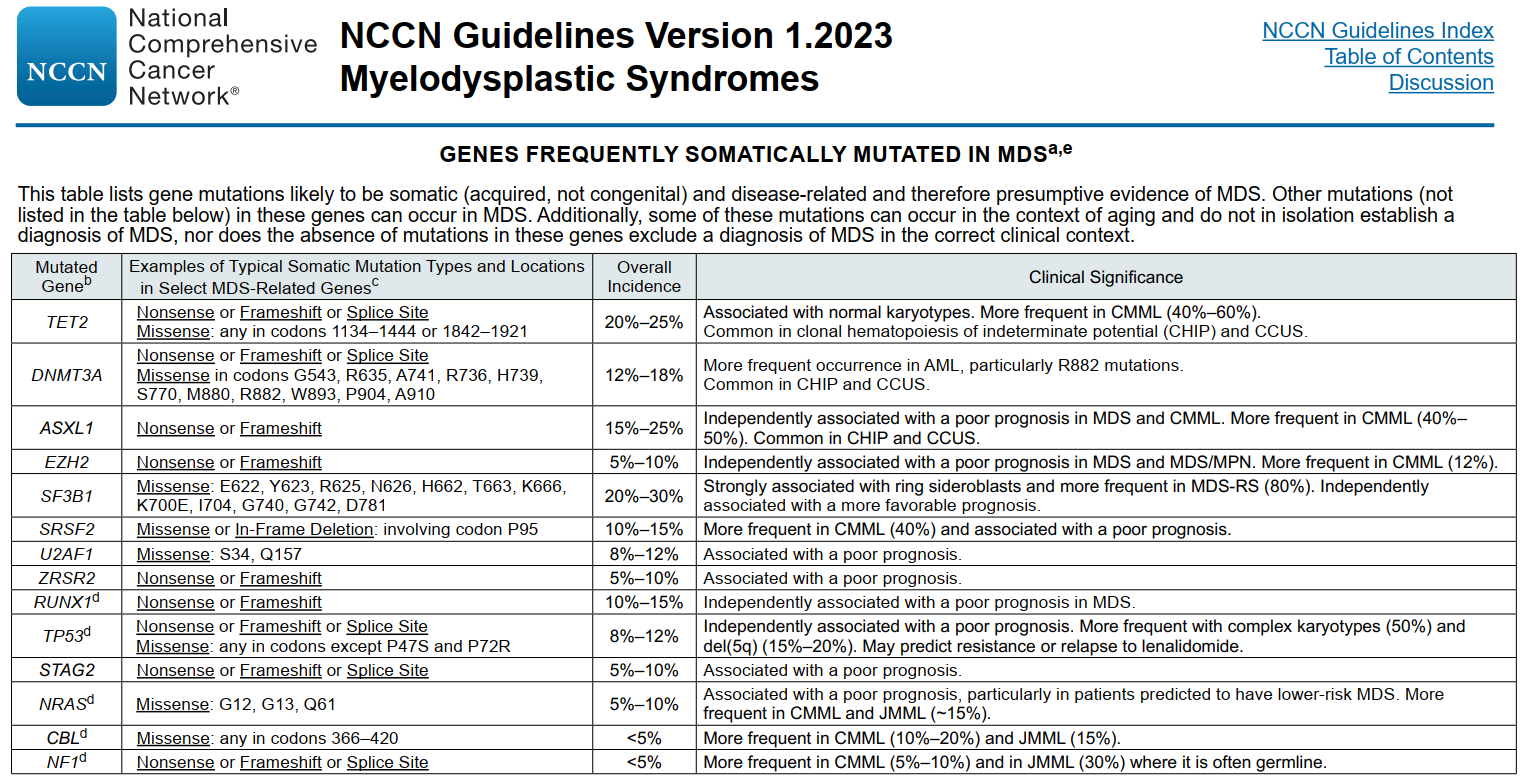
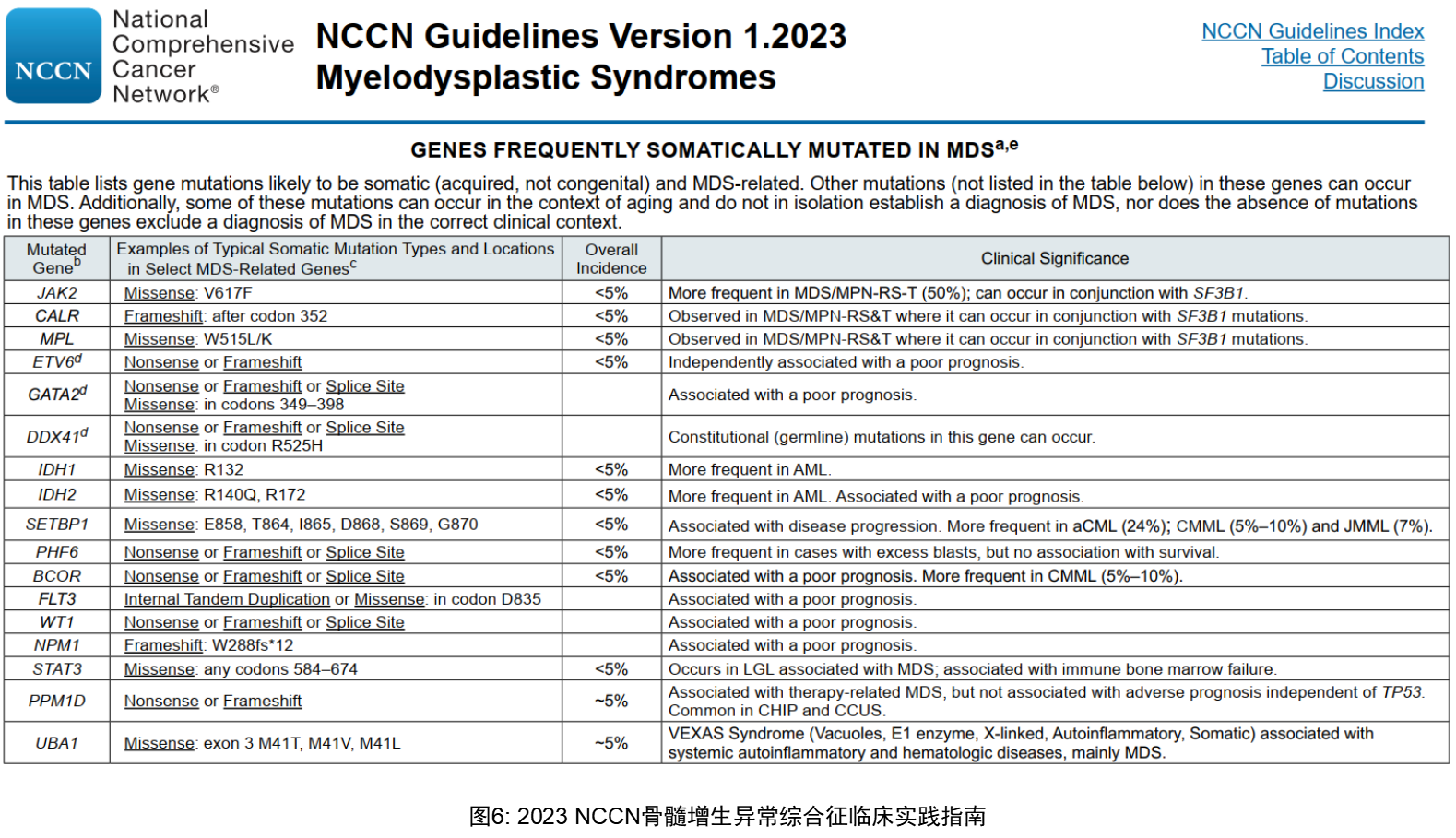
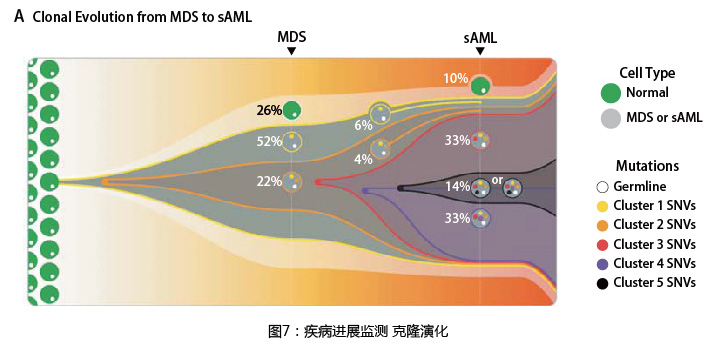
研究证实MDS会随着时间发生克隆演变,MDS阶段的亚克隆突变往往可以通过获得驱动突变,转化为侵袭性更高的AML,并成为转化后的AML的主克隆,目前已证实比如FLT3、NRAS、SETBP1突变是MDS疾病进程中的晚期事件,也即亚克隆,具有这些突变的患者往往预示着疾病向AML的转化及较差的预后。
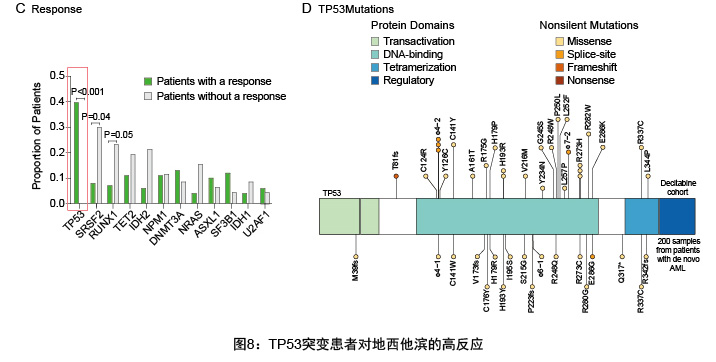
2023年NCCN《骨髓增生异常综合征临床实践指南》指出TP53属于预后不良因素,TP53基因常见突变为移码突变、无义突变、剪接突变和所有除P47S和P72R的非同义突变,在MDS中的发生比例为8%-12%,近年来的相关研究发现,TP53突变的MDS患者对地西他宾药物响应率较高。2016年一项对116名AML或MDS患者地西他宾用药效果的研究中,对患者使用地西他宾,以月为周期每月连续使用10天,发现发生TP53突变的患者相比未发生突变患者对地西他宾的响应率更高(21/21(100%)vs. 32/78(41%),p<0.001)。
| 临床热点 1 | 临床热点 2 |
| TET2、 DNMT3A、 ASXL1、 EZH2、 SF3B1、 SRSF2、 U2AF1、 ZRSR2、 TP53、 STAG2、 NRAS、 CBL、 JAK2、 RUNX1、 ETV6、 IDH1、 IDH2、 SETBP1、 PHF6、 BCOR、 PTPN11、 KRAS、 JAK3、 GATA2、 CEBPA、 BRAF、 CSF3R、 CALR、 MPL、 TERC、 NPM1、 PIGA、 DKC1、 PRPF8、 NF1、 STAT3、 TERT、 ETNK1、 DDX41、 SRP72、 ELA2、 HAX1、 GFI1、 BLM | ATRX、 BCORL1、 CDKN2A、 CREBBP、 CUX1、 DNAH9、 FLT3、 GNAS、 KDM6A、 KIT、 NT5C2、 PTEN、 RAD21、 SMC3、 SH2B3、 WT1 |
急性淋巴细胞白血病(ALL)是一种起源于淋巴细胞的B系或T系细胞在骨髓内异常增生的恶性肿瘤性疾病,异常增生的原始细胞可在骨髓聚集并抑制正常造血功能,同时也可侵及骨髓外的组织,其生物学特征多样,临床异质性大。ALL发病率在2-4岁会有一个高峰,随年龄增长发病率下降,60岁以后老年人又会形成第二个小高峰,所以说,ALL是“偏爱一老一小”的。
虽然多药联合化疗可使80%以上的初治成人ALL患者获得完全缓解,但50%以上的患者最终出现复发,5年无病生存率仅为30%-40%。儿童ALL的整体疗效较好,约80%-90%可获得长期无病生存,但仍有15%-20%的患儿出现缓解后复发,进一步提高化疗强度也很难提高疗效,部分患者还可能出现严重的毒副作用。
因此,根据ALL特有的细胞/分子遗传学变异,动态调整危险度分组,合理选择治疗方案,联合应用靶向药物,将有助于ALL的有效治疗。
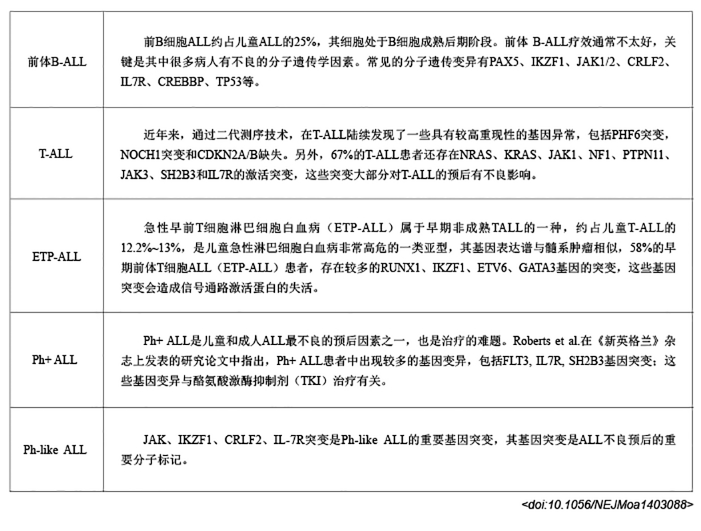
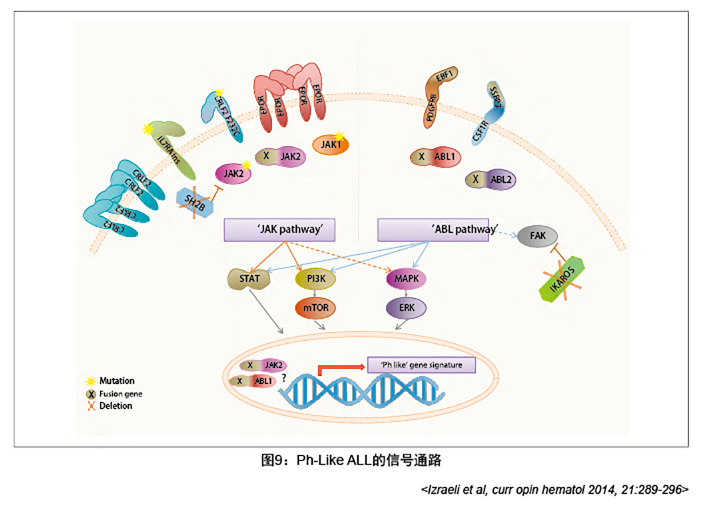
图10:Ph-like ALL 中淋系分化发育相关基因的异常
——常见有IKZF1、PAX5、ETV6、ERG等
MPNs是一组异质性疾病,起源于多能淋系-髓系干细胞或髓系祖细胞,以增殖性表型为主,也可出现病态造血。2008年的WHO将骨髓增殖性疾病(MPD)改为骨髓增殖性肿瘤(MPN),2016年的WHO修订中增加了分子指标在病种(类型)定义中的分量和诊断中的权重。目前,JAK2、MPL和CALR突变与真性红细胞增多症(PV)、特发性血小板增多症(ET)和原发性骨髓纤维化(PMF)的鉴别诊断有关,且携带有CALR突变的ET和PMF患者与JAK2 V617F突变患者相比,其平均年龄更低、栓塞风险更小、总生存期更长;CSF3R作为新增基因,其突变与慢性中性粒细胞白血病(CNL)有着高度特异性。随着分子研究的深入,ASXL1、RUNX1等预后相关基因逐渐受到重视,多基因突变研究在三阴性MPN患者(JAK2/CALR/MPL三个基因都是阴性)中尤为重要,ASXL1、EZH2、TET2、IDH1、IDH2、SRSF2、SF3B1等基因突变被指南推荐用于ET和prePMF的确诊和预后评估,为其生存差异的探索提供分子依据。
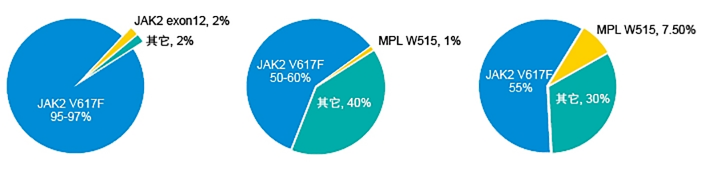
Oh ST et al. Therap Adv Hem. 2011;11-19.
Delhommeau F et al. Int J Hematol. 2010;91:165-173.
Vannucchi AM et al. Haematological. 2008;93:972-976.
| 疾病/可疑疾病 | 基因检测 | |
| 一线 | PV | JAK2 V617F |
| PMF/ET | JAK2 V617F, MPL W515L, CALR | |
| 二线 | PV | JAK2exon12,LNK |
| PMF | ASXL1, TET2, SRSF2,IDH1/2 | |
| PV (44%患者, mut>1) | TET2(18%), ASXL1(11%), SH2B3(5%), SF3B1(3%), SETBP1(<2%), IDH1, DNMT3A CEBPA, CSF3R, SUZ12, SRSF2, ZRSR2, TP53, CBL, NRAS, KIT, PTPN11, FLT3 |
| ET(46%患者, mut>1) | TET2(13%), ASXL1(11%), DNMT3A(6%), SF3B1(5%), CEBPA(4%), P53(<2%) SH2B3, EZH2, CSF3R |
| PMP (83%患者, mut≥1) | ASXL1(36%), TET2(18%), SRSF2(17%), U2AF1(17%), ZRSR2(11%), SF3B1(10%), DNMT3A(9%), CEBPA(9%), P53(7%), CBL(5%), IDH1/2(5%) |
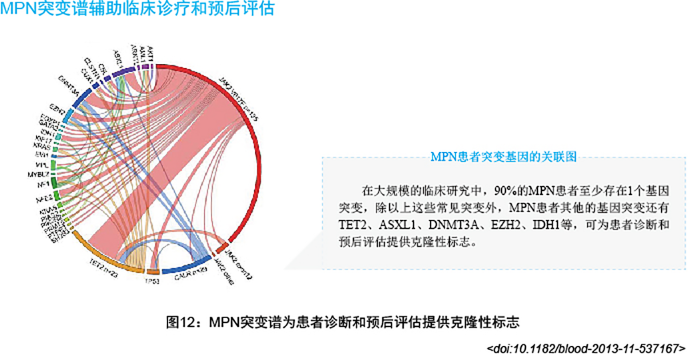
| Sum (90%患者, mut>1) | 多基因突变分析, 可为患者诊断提供克隆性标志参考 美国梅奥诊所 |
< J Clin Intern Med, March 2016, Vol.33, No.3>
| 临床热点 1 | 临床热点 2 |
| JAK2, MPL, CALR, CSF3R, ASXL1, EZH2, TET2, IDH1, IDH2, SRSF2, SF3B1, CBL, DNMT3A, IKZF1, KIT, ABL, SETBP1, SH2B3, KRAS, NRAS, ETV6, GATA2, RUNX1, NF1, TP53, U2AF1 | CBLC, CSF1R, EGFR, FAM46C, SMC3 |
“安百”化疗临床获益基因检测套餐,立足于临床常用化疗方案需求,征求多位全国血液科专家的建议,汇总NIH(美国国立卫生研究院)创建的药物基因组相关数据库PGKB信息,以及国际精准用药指南的发布机构CPIC(临床药理学实施联盟)的剂量建议,筛选出14种血液肿瘤常用化疗药物,包含46个位点的多态性基因检测,并以不同的证据等级呈现在报告中,为临床提供严谨、详实的化疗药物代谢毒副作用参考。
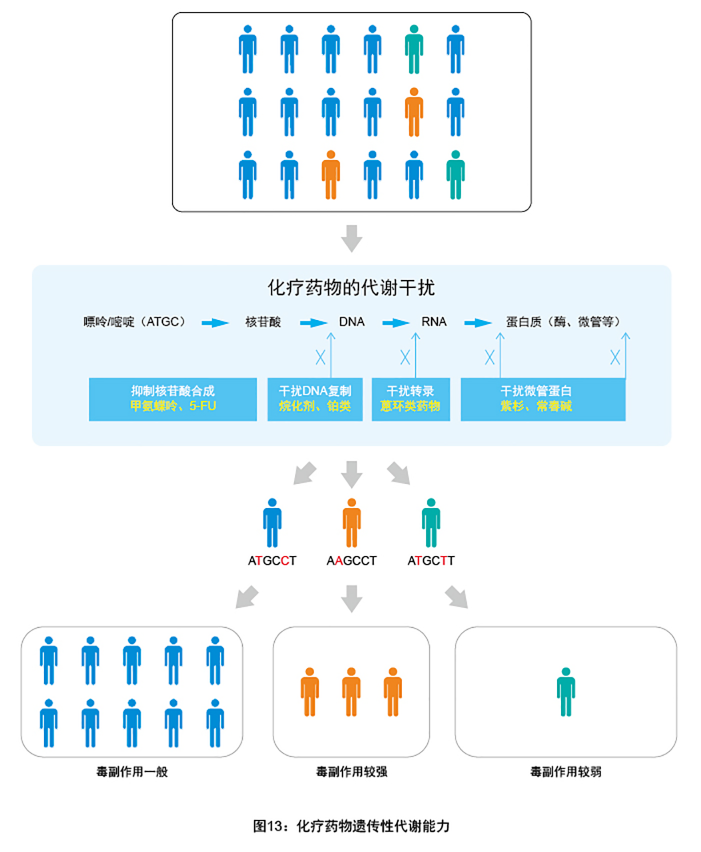
化疗是急性白血病的主要治疗方法,“早期、足量、联合和个体化”是急性白血病化疗方案的显著特点。虽然合理的方案和足量的化疗往往能在1个疗程内达到完全缓解,但是化疗药物的毒副作用也不容忽视,尤其是对于年龄偏小、偏大或体质差的患者。以蒽环类药物为例,包括阿霉素、表阿霉素、柔红霉素和阿克拉霉素等在内的蒽环类化疗药物广泛地用于治疗血液系统恶性肿瘤,其毒副作用也很受临床关注。我国蒽环类药物心脏毒性防治指南指出,葸环类药物没有绝对的“安全剂量”,可能原因为患者个体差异,即个体间遗传性药物代谢能力的差异性,导致其对蒽环类药物的易感性不同,毒副反应也有差异。
此外,还有多种血液病的化疗药物的代谢和遗传有关,如用于ALL诱导缓解治疗的门冬酰胺酶,用于ALL维持治疗的6-巯嘌呤(6-MP)和甲氨蝶呤(MTX),用于常规化疗的经典药物阿糖胞苷等,都有遗传相关的代谢能力差异。
化疗药物的临床获益,是针对于化疗药物代谢毒副作用的基因检测,即检测那些影响化疗药物代谢敏感性的基因多态性位点,用于科学地预测药物的疗效,为临床用药提供指导。在这个过程中,更多的药物相关信息、更高的参考等级、更详细的解读,是服务临床个性化用药的关键。




